Artikel dan Makalah tentang Enzim : Aktivitas, Sintesis, Induksi, Represi, Operon, Degradasi, Pengaturan, Katalitik - Sebuah sel hidup mempunyai ribuan enzim yang berbeda-beda. Masing-masing enzim merupakan katalis yang efektif bagi satu atau lebih reaksi biokimiawi. Sel tidak dapat berfungsi apabila semua enzim berkerja secara maksimal dan bersama-sama tanpa adanya mekanisme pengaturan yang tepat. Mekanisme pengaturan memungkinkan semua enzim tersebut bekerja serentak dan terkoordinasi sehingga semua kegiatan kimiawi di dalam sel menjadi terpadu. Dengan demikian sel hidup mampu mensintesis dan menguraikan bahan-bahan yang dibutuhkan bagi metabolisme dan pertumbuhan yang normal.
I. Pendahuluan
Salah satu ciri organisme hidup adalah memiliki mekanisme homeostasis, yaitu mekanisme pemeliharaan lingkungan internal agar relatif konstan meskipun terjadi fluktuasi lingkungan eksternal melalui perubahan reaksi biokimia sesuai kebutuhan fisiologis. Reaksi biokimia di dalam organisme dikatalis oleh enzim. Oleh sebab itu, pengaturan metabolisme selular pada akhirnya menyangkut pengaturan aktivitas enzim. Enzim yang bekerja pada kecepatan maksimumnya tidak dapat merespon peningkatan konsentrasi substrat, tetapi hanya dapat merespon penurunan konsentrasi substrat. Oleh karena itu, konsentrasi substrat intraselular bagi sebagian besar enzim cenderung berada di sekitar nilai Konstanta Michaelis-Menten (Km), sehingga perubahan konsentrasi substrat dapat direspon oleh enzim. Respon terhadap perubahan konsentrasi substrat merupakan mekanisme penting dalam homeostasis sel. Pengaturan ini disebut pengaturan pasif. Pengaturan tersebut hanya mampu merespon perubahan variabel lingkungan yang terbatas.
Dalam metabolisme selular, sejumlah enzim bekerja sama dalam satu rangkaian reaksi metabolisme. Dalam sistem tersebut, produk reaksi enzim yang satu merupakan substrat bagi enzim berikutnya. Pengaturan aktif homeostasis dilakukan terhadap enzim pertama dalam rangkaian tersebut karena reaksi pertama merupakan tempat pengaturan yang sangat sensitif. Ketika kecepatan reaksi enzim pertama menurun, seluruh reaksi enzim berikutnya juga akan menurun karena konsentrasi substrat yang tersedia juga menurun. Pengaturan aktivitas enzim penting untuk efisiensi penggunaan energi dan metabolit sel.
Pengaturan aktivitas enzim secara aktif meliputi pengaturan konsentrasi dan atau aktivitas katalitik enzim.
II. Pengaturan Konsentrasi Enzim
Konsentrasi sebagian besar enzim dipengaruhi oleh faktor fisiologis, hormonal atau diet. Konsentrasi enzim mencerminkan keseimbangan antara kecepatan sintesis dan degradasi enzim. Faktor yang mempengaruhi kecepatan sintesis enzim adalah induksi dan represi gen yang mengkode enzim atau laju degradasi mRNA yang dihasilkan gen tersebut. Kebanyakan enzim kunci yang berperan dalam pengaturan suatu jalur metabolisme memiliki umur mRNA yang pendek, sehingga laju sintesisnya mudah dikendalikan oleh faktor yang mempengaruhi laju transkripsi gennya.
2.1. Pengaturan Sintesis Enzim
Komponen utama enzim adalah protein sehingga sintesis enzim sangat terkait dengan proses ekspresi genetik. Oleh sebab itu, pengaturan sintesis enzim pada dasarnya adalah pengaturan ekspresi genetik. Terdapat dua macam pengaturan sintesis enzim, yaitu pengaturan positif dan pengaturan negatif. Pengaturan positif meningkatkan laju sintesis enzim, sedangkan pengaturan negatif menurunan laju sintesis enzim (Tabel 1). Pengaturan positif terjadi ketika pengikatan protein regulator pada DNA meningkatkan laju transkripsi, sebaliknya pengaturan negatif terjadi ketika pengikatan protein regulator mencegah proses transkripsi. Protein regulator pada pengaturan positif sintesis enzim disebut activator, sedangkan protein regulator pada pengaturan negatif disebut repressor.
Tabel 1. Pengaruh protein regulator terhadap kecepatan sintesis enzim
Protein Regulator | Kecepatan Sintesis Enzim | |
Pengaturan Positif | Pengaturan Negatif | |
Ada | Meningkat | Menurun |
Tidak ada | Menurun | Meningkat |
2.1.1. Enzyme Induction (Induksi Enzim)
Enzyme induction adalah sintesis enzim sebagai respon terhadap suatu sinyal (molekul inducer). Enzim yang disintesis dengan mekanisme ini disebut inducible enzyme. Enzim yang bersifat inducible umumnya terlibat dalam jalur katabolisme dan hanya disintesis hanya ketika diperlukan (ketika substrat tersedia). Enzim tersebut merupakan produk produk gen yang bersifat inducible. Pada umumnya gen inducible memiliki kecepatan basal transkripsi yang rendah, sehingga adanya inducer (substansi yang memacu transkripsi) akan meningkatkan laju sintesis enzim (Gambar 1). Molekul inducer adalah suatu substansi dengan berat molekul rendah dan dapat berupa substrat atau senyawa yang sekerabat (analog) dengan substrat.
 |
| Gambar 1. Perubahan konsentrasi enzim inducible pada saat penambahan inducer (laktosa) |
Mekanisme pengaturan sintesis enzim telah banyak dipelajari pada bakteri dengan menggunakan model operon (dikemukakan oleh Francois Jacob dan Jackues Monod, 1961). Operon terdiri atas serangkaian gen struktural yang mengkode protein yang terlibat dalam suatu proses metabolisme tertentu. Situs operator ialah sekuen DNA yang mengatur transkripsi gen struktural dan gen regulator yang mengkode protein yang mengenali daerah operator. Pada banyak bakteri, gen-gen struktural yang menentukan sintesis enzim dalam suatu lintasan metabolik tertentu ditempatkan menurut urutan sesuai dengan rangkaian reaksi pada lintasan tersebut. Hal ini menunjukkan bahwa urutan reaksi pada lintasan metabolik dikendalikan oleh kromosom.
a. lac operon
Agar laktosa dapat digunakan oleh bakteri, laktosa harus dihidrolisis terlebih dulu menjadi galaktosa dan glukosa dengan enzim β-galaktosidase. Gen struktural untuk β-galaktosidase (lacZ) terletak bersebelahan dengan gen untuk permease yang bertanggung jawab terhadap pengambilan laktosa ke dalam sel (lacY) dan untuk thiogalaktosida transasetilase (enzim untuk detoksifikasi senyawa toksik yang juga dapat masuk melalui permease) (lacA). Ketiga gen struktural tersebut besama dengan promoter lac (daerah tempat pelekatan RNA polimerase pada saat inisiasi transkripsi) dan operator lac (daerah pengaturan) sangat berkaitan erat membentuk lac operon (Gambar 2).
 |
| Gambar 2. Struktur lac operon. |
Rangkaian genetik tersebut memungkinkan koordinasi ekspresi ketiga enzim/protein terkait dengan metabolisme laktosa. Ketiga gen tersebut ditranskripsikan menjadi satu molekul mRNA besar yang mengandung kodon start (AUG) dan kodon stop (UAA) untuk setiap bagian sistron (unit terkecil ekspresi genetik). Dengan demikian protein akan ditranslasikan secara terpisah.
b. Pengaturan Negatif lac operon
Ketika E. coli dikulturkan pada media yang mengandung laktosa (tanpa/sedikit glukosa) dengan kondisi yang sesuai, sintesis β-galaktosidase, galaktosida permease dan thiogalaktosida transasetilase meningkat 100-1000 kali. Namun, ketika laktosa (inducer) dihilangkan, sintesis ketiga enzim tersebut menurun seketika. Mekanisme peningkatan sintesis enzim yang ditingkatkan oleh adanya inducer disebut induksi, sedangkan enzim yang disintesis disebut inducible enzyme.
Fisiologi induksi lac operon telah dipelajari pada aras molekular. Ekspresi gen lacI bersifat konstitutif yang berarti diekspresikan pada kecepatan yang konstan. Gen tersebut menghasilkan LacI repressor yang terdiri dari 4 subunit identik dengan berat 38.000. Afinitas molekul lac repressor sangat tinggi (Kd sekitar 10–13 mol/l) terhadap lokus operator. Lokus operator terletak antara promoter dan situs inisiasi transkripsi gen lacZ. Pelekatan LacI repressor pada operator menyebabkan transkripsi ketiga gen struktural (lacZ, lacY, and lacA) terhambat. Oleh karena itu, molekul LacI repressor disebut regulator negatif. Molekul LacI repressor secara alami menjaga transkripsi gen lac operon gene tetap rendah tanpa adanya inducer.
Sedikit molekul β-galaktosidase di dalam sel sebelum induksi akan mengubah laktosa menjadi allolaktosa yang kemudian memicu transkripsi gen lac operon, sehingga allolaktosa disebut inducer. Suatu analog laktosa (isopropylthiogalactoside/IPTG) yang bukan merupakan substrat β-galaktosidase dan mampu menginduksi lac operon disebut gratuitous inducer. Penambahan laktosa atau IPTG kedalam media bakteri yang mengandung sedikit sumber karbon menyebabkan induksi enzim lac operon. Sejumlah kecil laktosa atau IPTG dapat masuk kedalam sel tanpa permease. Molekul LacI repressor baik yang melekat pada lokus operator maupun yang terdapat bebas dalam sitosol memiliki afinitas tinggi terhadap inducer. Pengikatan inducer ke molekul repressor yang melekat pada operator menyebabkan perubahan konformasi molekul repressor sehingga molekul repressor terdisosiasi dari DNA karena afinitasnya terhadap operator menurun 103 kali (Kd sekitar 10–9 mol/l). Apabila RNA polimerase telah melekat pada promoter, transkripsi segera dimulai (Gambar 3).
 |
| Gambar 3. Mekanisme induksi pada pengaturan negatif lac operon. |
c. Pengaturan Positif lac operon
Ketika E. coli dikulturkan pada media yang mengandung laktosa dan glukosa sebagai sumber karbon, bakteri tersebut pertama akan memetabolisme glukosa kemudian berhenti tumbuh sebentar sampai lac operon terinduksi untuk menyediakan kemampuan memetabolisme laktosa. Meskipun laktosa tersedia sejak awal pertumbuhan bakteri, sel tersebut tidak menginduksi enzim yang diperlukan untuk katabolisme laktosa sampai glukosa habis. Fenomena ini menunjukkan bahwa terjadi represi lac operon oleh beberapa katabolit glukosa, sehingga mekanisme ini disebut catabolite repression (Gambar 4).
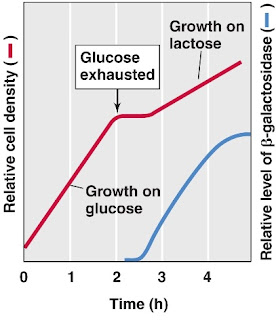 |
| Gambar 4. Mekanisme catabolite repression pada E. coli. |
Saat ini telah diketahui bahwa catabolite repression diperantarai catabolite activator protein (CAP) yang berikatan dengan Cyclic Adenosine Monophosphate (cAMP). Protein tersebut juga disebut cAMP receptor protein (CRP). Agar RNA polimerase dapat melekat pada promoter secara efisien, diperlukan CAP dimana cAMP terikat. cAMP hanya terakumulasi ketika bakteri kekurangan sumber karbon. Glukosa dalam konsentrasi yang cukup untuk pertumbuhan menghambat adenilat siklase, yakni enzim yang mengkatalisis perubahan ATP menjadi cAMP. Dengan demikian, adanya glukosa menyebabkan jumlah kompleks CAP-cAMP rendah sehingga RNA polimerase tidak dapat memulai transkripsi lac operon. Pelekatan kompleks CAP-cAMP pada daerah upstream pomoter menyebabkan transkripsi berlangsung. Pada saat, tidak terdapat glukosa dan laktosa ada, kompleks CAP-cAMP menstimulasi transkripsi gen lac operon agar dapat menggunakan laktosa sebagai sumber karbon. Ketidaktersediaan laktosa menyebabkan lac operon tetap tidak aktif. Kombinasi tersebut menyebabkan gen lac operon hanya akan ditranskripsi kuat pada saat glukosa tidak ada dan laktosa ada. Regulator CAP-cAMP adalah regulator positif karena keberadaannya diperlukan untuk ekspresi genetik (Gambar 5).
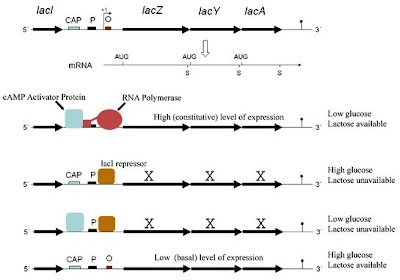 |
| Gambar 5. Mekanisme represi dan induksi pada lac operon. |
2.1.2. Enzyme Repression
Enzyme repression adalah penghentian sintesis enzim sebagai respon terhadap keberadaan suatu molekul (repressor). Enzim yang disintesis dengan mekanisme ini disebut repressible enzyme. Enzim yang bersifat repressible umumnya terlibat dalam jalur biosintesis dan hanya disintesis ketika molekul hasil sintesis jalur tersebut tidak tersedia. Enzim yang bersifat repressible merupakan produk gen yang bersifat repressible. Gen tersebut memiliki kecepatan basal transkripsi yang tinggi, sehingga akumulasi produk akhir (repressor) akan menghentikan sintesis enzim (Gambar 6).
 |
| Gambar 6. Perubahan konsentrasi enzim repressible pada saat penambahan repressor (arginin) |
a. trp operon
trp operon terdiri dari 5 gen struktural yang mengkode enzim untuk biosintesis triptofan. Bagian operator tumpang tindih dengan bagian promoter. Gen dalam operon ditranskripsi ketika sel kekurangan triptofan. Gen trp repressor mengkode Trp repressor yang secara alami bersifat inaktif, sehingga tidak dapat menempel pada trp operator. Ketika triptofan tidak tersedia, Trp repressor tetap bersifat inaktif, sehingga trp operon ditranskripsikan untuk menghasilkan enzim yang digunakan untuk biosintesis triptofan.
Ketika triptofan tersedia, enzim untuk biositesis triptofan tidak diperlukan sehingga ekspresi gen tersebut harus dihentikan. Triptofan akan menempel pada Trp repressor, sehingga menyebabkan Trp repressor berada dalam konformasi aktifnya. Trp repressor yang aktif mampu berikatan dengan operator sehingga menghentikan transkirpsi trp operon. Dalam hal ini, triptofan disebut co-repressor dan mekanisme pengaturan ini disebut pengaturan negatif karena terikatnya repressor mencegah transkripsi (Gambar 7).
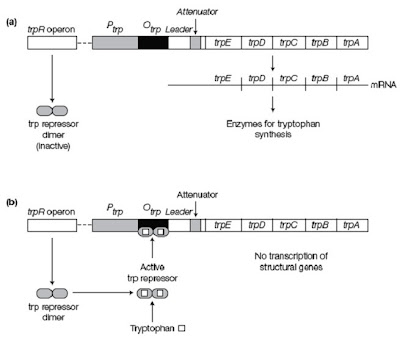 |
| Gambar 7. Mekanisme represi pada pengaturan trp operon. |
2.2. Pengaturan Degradasi Enzim
Enzim didegradasi melalui jalur yang sama dengan jalur degradasi protein. Pada sel hewan, sebagian besar enzim didegradasi melalui jalur ubiquitin proteasome. Proteasome terdiri dari 30 subunit polipeptida yang terangkai menjadi bentuk silinder kosong. Sisi aktif proteolitik proteasome menghadap sisi dalam silinder sehingga mencegah degradasi protein selular yang lain. Protein yang akan didegradasi ditandai melalui proses ubiquitination, yakni pelekatan satu atau lebih molekul ubiquitin secara kovalen. Ubiquitination dikatalis oleh keluarga enzim E3 ligase. Jalur ubiquitin proteasome bertanggungjawab atas pengaturan degradasi selektif protein selular yang tidak sempurna/rusak. Selektivitas sistem ubiquitin proteasome disebabkan baik karena keragaman enzim E3 ligase maupun kemampuannya untuk membedakan konformasi protein target.
Sintesis enzim merupakan proses yang terdiri dari banyak tahap dan umumnya memerlukan waktu lama (jam) untuk meningkatkan konsentrasi enzim sampai cukup. Sebaliknya, perubahan aktivitas katalitik enzim dapat diselesaikan dalam waktu cepat (detik). Perubahan konsentrasi enzim digunakan untuk adaptasi jangka panjang, sedangkan perubahan aktivitas katalitik enzim sangat sesuai untuk merespon fluktuasi metabolit yang bersifat cepat dan sementara.
3.1. Pengaturan Langsung
Pengaturan langsung aktivitas katalitik enzim dapat terjadi dengan mengubah konsentrasi substrat atau reaktan. Apabila konsentrasi subtrat bertambah, maka laju reaksi meningkat sampai tercapai nilai pembatas (kejenuhan), sedangkan apabila produk menumpuk, laju reaksi menurun. Selain itu, konsentrasi koenzim dan kofaktor juga dapat memberikan pengaruh terhadap pengaturan aktivitas enzim di dalam sel.
Tipe pengaturan ini dapat juga disebabkan oleh adanya penggolongan enzim di dalam sel, yakni enzim dapat terikat pada berbagai struktur internal, terutama membran dan makromolekul, sehingga enzim dan substrat tidak berada dalam kontak langsung. Pada beberapa mikrobia, enzim proteolitik (perombak protein) yang sangat spesifik menguraikan enzim lain yang tidak lagi dibutuhkan untuk reaksi-reaksi metabolik.
3.2. Modifikasi Kovalen Reversible
Pengaturan aktivitas enzim dapat dilakukan dengan memodifikasi molekul enzim melalui pengikatan suatu gugus secara kovalen. Pengaturan ini tidak mengubah laju ekspresi gen, tetapi mempengaruhi enzim pertama dari suatu rangkaian reaksi biosintesis. Pengikatan gugus tersebut merupakan suatu proses yang reversible dan dikatalis oleh enzim khusus. Gugus yang biasa digunakan untuk memodifikasi molekul enzim antara lain fosforil, adenilil, uridilil, metil, dan adenosine diphosphate ribosyl. Pada sel mamalia, gugus yang biasa digunakan adalah gugus fosforil. Fosforilasi (penambahan gugus fosforil) merupakan proses reversible yang dikatalis oleh enzim protein kinase, sedangkan hidrolisis gugus fosforil dikatalis oleh enzim protein fosfatase. Protein kinase dapat dikelompokkan menjadi 2 kelas, yaitu protein kinase kelas I yang memindahkan fosfat terutama ke gugus hidroksil residu serin atau treoinin enzim target, sedangkan kelas II memindahkan fosfat ke residu tirosin. Baik aktivitas protein kinase maupun protein fosfatase memiliki pengaturan tersendiri untuk menghindari proses yang secara termodinamik tidak produktif (Gambar 8).
 |
| Gambar 8. Modifikasi kovalen melalui penambahan dan pelepasan gugus fosforil. |
Fosforilasi dan defosforilasi merupakan proses yang selektif, tidak semua enzim dan gugus hidroksil pada permukaan enzim menjadi target fosforilasi. Perubahan frekuensi fosforilasi (penambahan gugus fosforil) dan defosforilasi (pelepasan gugus fosforil) merupakan mekanisme pengaturan aktivitas enzim. Fosforilasi dan defosforilasi menyebabkan perubahan fungsional suatu enzim selama aktivitas enzim tersebut diperlukan. Ketika aktivitas enzim tidak diperlukan lagi, enzim tersebut dapat diubah kembali menjadi bentuk awalnya sehingga siap untuk merespon rangsangan berikutnya. Oleh karena itu, fosforilasi dan defosforilasi dapat digunakan untuk pengaturan jalur metabolisme secara cepat dan reversible sesuai dengan kebutuhan sel.
Kemampuan fosforilasi dan defosforilasi untuk mengubah struktur dan fungsi enzim disebabkan karena sifat gugus fosforil yang memiliki muatan besar dan cenderung untuk membentuk jembatan garam diantara residu-residu arginil. Fosforilasi umumnya terjadi pada asam amino yang terletak jauh dari sisi katalitik enzim, tetapi sangat menentukan struktur 3 dimensi protein, sehingga fosforilasi dapat memiliki pengaruh yang dramatis terhadap konformasi enzim dan efisiensi katalitiknya. Selain itu, fosforilasi juga dapat mengubah letak enzim di dalam sel, kerentanan terhadap degradasi proteolitik, atau responsifitasnya terhadap ligand allosterik. Dengan demikian fosforilasi mampu mempengaruhi efisiensi katalitik maupun mengubah enzim menjadi inaktif.
Fosforilasi dan defosforilasi merupakan pengaturan aktivitas enzim sebagai respon terhadap sinyal fisiologis spesifik. Pengaturan tersebut melibatkan beberapa protein dan ATP dibawah kendali syaraf dan hormonal secara langsung. Baik protein kinase maupun protein fosfatase dapat berubah dari bentuk inaktif menjadi aktif akibat pengikatan second messenger atau modifikasi kovalen fosforilasi dan defosforilasi. Salah satu contoh penting pengaturan fosforilasi adalah pada glikogen fosforilase yang mengkatalis reaksi pemecahan glikogen menjadi glukosa dalam otot dan hati. Glikogen fosforilase terdapat dalam dua bentuk, bentuk yang lebih aktif adalah bentuk yang terfosforilasi pada gugus hidroksil residu serin (Gambar 9).
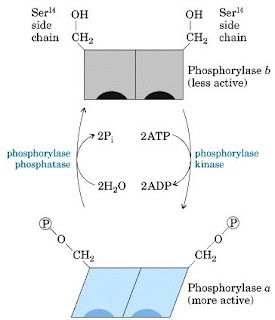 |
| Gambar 9. Pengaturan aktivitas glikogen fosforilase dengan modifikasi kovalen. |
Fosforilasi dan defosforilasi digunakan sebagai mekanisme pengaturan aktivitas enzim karena memiliki beberapa kelebihan, yaitu 1. Bersifat reversible sehingga enzim dapat dengan cepat diubah menjadi bentuk aktif atau inaktif. 2. Tidak memerlukan banyak energi karena tidak melibatkan sintesis enzim atau protein inhibitor. 3. Cepat sehingga waktunya dapat disesuaikan dengan kebutuhan fisiologis sel. 4. Efeknya dapat diperbesar secara cepat melalui kinase cascade.
3.3. Feedback Inhibition
Feedback inhibition merupakan suatu mekanisme penghambatan aktivitas enzim pertama dalam jalur biosintesis oleh produk akhir jalur tersebut. Reaksi pertama dalam jalur biosintesis menghasilkan produk intermediet yang digunakan oleh enzim berikutnya sebagai substrat. Dengan demikian, penghambatan aktivitas enzim pada reaksi pertama dapat menghindarkan sel dari penggunaan persediaan energi dan pembentukan produk intermediet yang tidak diperlukan.
Pada contoh berikut (Gambar 10), biosintesis Z dari prekursor A dikatalis oleh serangkaian enzim (E1 – En). Konsentrasi Z yang tinggi menghambat perubahan A menjadi B. Penghambatan terjadi karena Z mampu terikat pada enzim 1 (E1) pada sisi selain sisi katalitik. Pengikatan Z pada E1 menyebabkan perubahan konformasi yang menurunkan efisiensi katalitiknya. Dalam contoh ini, Z adalah modulator negatif/inhibitor E1.
 |
| Gambar 10. Skema mekanisme feedback inhibition pada suatu jalur biosintesis. |
Pada jalur biosintesis yang bercabang, reaksi awal menyebabkan sintesis beberapa produk. Pada contoh berikut(Gambar 10), baik Y maupun Z disintesis dari prekursor yang sama (A) melalui jalur yang berbeda. Akumulasi Y menyebabkan penghambatan pada enzim 3* (E3*) yang mengkatalis perubahan C menjadi D. Di sisi lain, akumulasi Z menyebabkan penghambatan pada enzim 3 (E3) yang mengkatalis perubahan C menjadi E. Penghambatan tersebut menyebabkan C terakumulasi karena tidak digunakan untuk reaksi berikutnya. Akumulasi C selanjutnya menghambat enzim 1 (E1) yang mengkatalis reaksi pertama dalam jalur tersebut. Mekanisme penghambatan ini tetap memungkinkan sintesis suatu produk akhir dari suatu cabang meskipun sintesis produk akhir yang lain dari cabang yang berbeda dihambat. Pengaturan ini disebut sequential feedback inhibition.
Feedback inhibitor umumnya berupa molekul kecil yang merupakan building block makromolekul dan umumnya menghambat reaksi pertama suatu jalur biosintesis. Mekanisme multiple feedback loop menyediakan pengaturan lain yang lebih kompleks. Pada contoh berikut (Gambar 6), produk B yang terakumulasi menghambat perubahan S1 menjadi S2, sehingga menghambat sintesis ketiga produk lainnya (A, C, D). Namun, umumnya setiap produk akhir hanya menghambat aktivitas katalitik secara parsial. Pengaruh penghambatan aktivitas enzim oleh 2 atau lebih produk akhir yang lebih besar dari pengaruh individualnya disebut cooperative feedback inhibition (Garis putus-putus, Gambar 11).
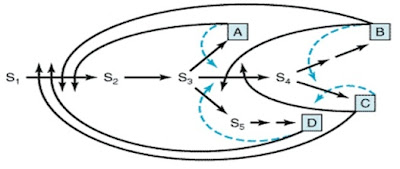 |
| Gambar 11. Skema mekanisme multiple feedback inhibition pada suatu jalur biosintesis Garis tegas: feedback inhibition sederhana, Garis putus-putus: cooperative feedback inhibition. |
Karena struktur molekul produk akhir suatu jalur metabolisme berbeda dengan struktur molekul prekursor yang digunakan, produk akhir akan mengikat enzim pada sisi selain sisi aktif. Pengikatan tersebut diperantarai ikatan nonkovalen sehingga bersifat reversible, sehingga apabila konsentrasi produk akhir berkurang kecepatan reaksi akan meningkat. Enzim yang memiliki sifat tersebut disebut enzim allosterik. Enzim allosterik mampu merespon secara cepat dan reversible terhadap fluktuasi konsentrasi produk akhir suatu jalur biosintesis di dalam sel.
Salam satu contoh mekanisme feedback inhibition enzim allosterik adalah perubahan L-threonine menjadi L-isoleucine dalam 5 langkah reaksi. Pada sistem tersebut, enzim pertama (threonine dehydratase) dihambat oleh isoleusin yang merupakan produk terakhir rangkaian reaksi. Isoleusin bersifat spesifik, tidak ada senyawa intermediet dalam rangkaian reaksi tersebut yang menghambat threonine dehydratase, demikian juga tidak ada enzim lain dalam rangkaian reaksi tersebut yang dihambat oleh isoleusin (Gambar 12).
 |
| Gambar 12. Skema mekanisme feedback inhibition enzim allosterik dalam perubahan L-threonine menjadi L-isoleucine. |
3.4. Enzim Allosterik
Allosteric berasal dari kata Yunani, 'allo' berarti lain dan 'steric' berarti tempat atau sisi. Sehingga allosterik berarti sisi lain, dan enzim allosterik adalah enzim yang memiliki 2 sisi pengikatan, satu sisi untuk substrat dan sisi yang lain untuk molekul efektor/modulator. Aktivitas sisi aktif enzim allosterik dapat dimodulasi oleh efektor/modulator pada sisi selain sisi aktif. Modulator yang meningkatkan kecepatan reaksi dan afinitasnya terhadap substrat disebut modulator positif/activator, sedangkan yang menurunkan kecepatan reaksi dan afinitasnya terhadap substrat disebut modulator negatif/inhibitor. Pada umumnya pengikatan modulator allosterik menginduksi perubahan konformasi sisi aktif enzim. Perubahan tersebut dapat berpengaruh pada efisiensi katalitik suatu enzim, afinitas terhadap substrat atau keduanya. Dengan demikian enzim allosterik umumnya berupa enzim multisubunit dengan satu atau lebih sisi aktif setiap subunit.
Seringkali modulator enzim allosterik adalah substratnya sendiri, sehingga substrat dan modulatornya identik. Enzim allosterik yang demikian disebut allosterik homotropic. Namun, apabila modulatornya adalah molekul lain selain substrat, maka disebut allosterik heterotropic. Enzim allosterik umumnya memiliki lebih dari 1 sisi pengikat modulator. Sisi pengikat tersebut spesifik terhadap modulatornya. Enzim allosterik dengan beberapa modulator umumnya memiliki sisi pengikatan spesifik yang berbeda untuk setiap modulator. Pada enzim allosterik homotropic, sisi aktif dan sisi pengaturannya sama (Gambar 13).
 |
| Gambar 13. Interaksi enzim allosterik dengan aktivator, inhibitor dan substratnya. |
Kurva kinetika kecepatan reaksi yang dikatalis oleh enzim allosterik menunjukkan terjadi peningkatan kecepatan secara tajam pada kisaran sempit konsentrasi substrat (Gambar 14). Hal ini menunjukkan bahwa enzim allosterik sensitif terhadap perubahan kecil konsentrasi substrat dalam rentang fisiologis. Kinetika sigmoid juga mencerminkan interaksi kooperatif diantara subunit protein. Dengan kata lain, perubahan struktur satu subunit akibat pengikatan substrat menyebabkan perubahan struktur subunit yang berdekatan sehingga afinitas terhadap substratnya meningkat. Pengaruh tersebut diperantarai interaksi nonkovalen pada permukaan antar subunit.
 |
| Gambar 14. Kurva kinetika kecepatan reaksi yang dikatalis oleh enzim allosterik. + : terdapat aktivator, - : terdapat inhibitor |
IV. Pengaturan Dengan Proteolitik
Beberapa protein disintesis dan disekresikan dalam bentuk prekursor tidak aktif yang disebut proprotein. Proprotein enzim disebut proenzim atau zymogen. Proteolisis selektif terhadap suatu proenzim atau zymogen melalui pemotongan bertahap akan membentuk enzim yang aktif. Pemotongan spesifik menyebabkan perubahan konformasi yang menyingkap sisi aktif enzim. Mekanisme pengaturan ini dapat dilakukan di luar sel karena tidak memerlukan ATP untuk mngubah zymogen menjadi enzim aktif. Karena mekanisme ini bersifat irreversible, maka diperlukan mekanisme lain untuk menginaktifkan enzim. Protease diinaktifkan dengan protein inhibitor yang mengikat secara kuat pada sisi aktif enzim.
Enzim yang memerlukan mekanisme tersebut antara lain pepsin (proenzim = pepsinogen), tripsin (proenzim = tripsinogen), khimotripsin (proenzim = khimotripsinogen) dan beberapa enzim yang terlibat dalam proses pembekuan darah (Gambar 15). Sintesis dan sekresi enzim protease dalam bentuk inaktif melindungi jaringan asal (misalnya pankreas) dari autodigestion seperti pada pancreatitis. Selain mensintesis dan mensekresikan zymogen, pankreas juga mensintesis trypsin-inhibitor protein yang terikat kuat pada sisi aktif tripsin sehingga mencegah autodigestion. Selain itu, enzim yang diperlukan dalam sementara tetapi cepat juga disintesis dan disekresikan dalam bentuk inatif. Hal ini dikarenakan proses sintesis enzim baru dan sekresinya memerlukan waktu lama sehingga tidak cukup cepat untuk mencegah konsisi patofisiologis seperti perdarahan.
 |
| Gambar 15. Aktivasi zimogen dengan pemotongan proteolitik. a. Aktivasi khimotripsinogen menjadi α- khimotripsinogen, b. Aktivasi tripsinogen menjadi tripsin. |
V. Pengendalian Yang Berkaitan Dengan Energi
Ligan pengatur yang terlibat dalam reaksi-reaksi yang berkaitan dengan energi ialah adenilat, seperti adenosin trifosfat (ATP) atau nukleotida purin / pirimidin. Beberapa enzim sensitif terhadap konsentrasi mutlak ATP, adenosin difosfat (ADP), atau adenosin monofosfat (AMP); enzim yang lain sensitif terhadap perbandingan antar dua dari ketiga nukleotida tersebut. Pada umumnya enzim yang berperan dalam pembentukan energi dihambat oleh muatan energi yang tinggi (misalnya, konsentrasi ATP yang tinggi), sedangkan beberapa enzim biosintetik yang penting justru dirangsang. Pengaturan semacam itu sangat penting untuk menyeimbangkan produksi dan penggunaan energi.
Daftar Pustaka
Berg, J.M., J.L. Tymoczko and L. Stryer. 2000. Biochemistry. 5th edition. W.H. Freeman and Company. www.whfreeman.com/biochem5.
Hames, D. and N. Hooper. 2005. Instant Notes in Biochemistry. 3rd edition. Taylor & Francis Group. Abingdon, UK.
Murray, R.K., D.K. Granner and V.W. Rodwell. 2006. Harper's Illustrated Biochemistry. 27th Edition. The McGraw-Hill Companies, Inc. USA.
Nelson, D.L. and M.M. Cox. 2004. Lehninger Principles of Biochemistry. 4th Editoin. W.H. Freeman. www.whfreeman.com/lehninger4e.
Pelczar, M.J. 1986. Dasar-dasar Mikrobiologi. UI-Press. Jakarta.
Anda sekarang sudah mengetahui Enzim : Aktivitas, Sintesis, Induksi, Represi, Operon, Degradasi, Pengaturan, Katalitik. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Anda sekarang sudah mengetahui Enzim : Aktivitas, Sintesis, Induksi, Represi, Operon, Degradasi, Pengaturan, Katalitik. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.


0 comments:
Post a Comment